Konstituierende Elemente von Knorpel, Sehnen und Bändern
Die Gewebe von Knorpel, Sehnen und Bändern haben starke gemeinsame Merkmale. Im wissenschaftlichen Sprachgebrauch sind sie Teil der “extrazellulären Matrix”, im Alltag werden sie als “Bindegewebe” bezeichnet. Die Bestandteile des Bindegewebes sind für Knorpel, Sehnen, Bänder und Haut (insbesondere in den subkutanen Schichten, der Unterhaut, der Hypodermis) die gleichen: Kollagenfasern, Elastinfasern und Proteoglykane.
Strukturproteine
Kollagen ist ein Protein, das nur bei Menschen und Tieren vorkommt. Pflanzen enthalten keine Kollagenfasern. Kollagen ist das häufigste Protein im menschlichen Körper und besteht aus Aminosäuren, die in einer bestimmten Reihenfolge zusammengesetzt sind. Kollagenfasern sind sehr zugfest und dehnen sich kaum aus. Sie verleihen unserem Gewebe eine starke Struktur und Stärke. Diese Kollagenproteine werden als “Strukturproteine” bezeichnet. Es wird zwischen folgenden Kollagentypen unterschieden: Typ 1 und 3 befinden sich vor allem in der Haut, in Sehnen, Bändern, Knochen und Zähnen. Kollagen Typ 2 befindet sich weitgehend im Knorpel der Gelenke (hyaliner und elastischer Knorpel).
Kollagen besteht aus drei langen Ketten von Proteinen, die über Disulfidbrücken und Wasserstoffbrücken miteinander verbunden sind. Diese drei langen Proteinketten bilden zusammen ein Tripelhelix-Kollagen (siehe Zeichnung).
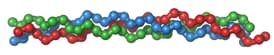
Zeichnung: Dreifachhelix-Kollagen
Mehrere Kollagen-Dreifachspiralen bilden eine Fibrille und mehrere Fibrillen bilden dann eine Kollagenfaser. Man kann sich vorstellen, dass eine Kollagenfaser wie ein riesiges Stahlseil aussieht, wie die extrem starken und stabilen Seile, die für Seilbahnen verwendet werden.
Aminosäuren
Die kleinsten Bausteine der Kollagen- und Elastinfasern sind die Aminosäuren. Heute wissen wir von insgesamt zwanzig Arten von Aminosäuren, die in allen Proteinen des menschlichen Körpers vorkommen. Von diesen zwanzig Aminosäuren sind acht essentiell, d.h. sie werden vom menschlichen Körper nicht gebildet (Isoleucin, Leucin, Lysin, Methionin, Phenylalanin, Threonin, Tryptophan, Valin). Wenn eine essentielle Aminosäure nur in unzureichender Menge zur Verfügung steht, können die anderen Aminosäuren nicht für die Bildung neuer Proteine verwendet werden und werden in Fett und Zucker umgewandelt. Auf diese Weise benötigt der menschliche Körper eine ausreichende Menge an essentiellen Aminosäuren aus der normalen Ernährung.
Im Kollagen sind insbesondere die folgenden Aminosäuren vertreten: Glycin, Prolin, Hydroxyprolin und Hydroxylysin. Threonin, eine essentielle Aminosäure, ist ein Vorläufer der Glycinsynthese. Lysin ist für die Synthese von Kollagen- und Elastinfasern im Bindegewebe unerlässlich.
Proteoglykane
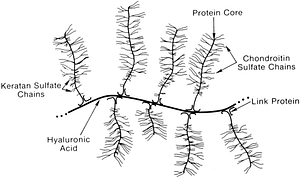 Proteoglykane haben eine hohe Kapazität Wassermoleküle zu binden. Sie verleihen dem Bindegewebe die typische gelatinöse Konsistenz. Proteoglykane befinden sich zwischen den Kollagen- und Elastinfasern und dank ihrer starken Fähigkeit, Wassermoleküle zu binden, ernähren sie das umliegende Gewebe und transportieren Moleküle zu den Zellen. Die Form der Proteoglykane kann man sich wie den Stamm eines Tannenbaums vorstellen: Der Stamm besteht aus Hyaluronsäure und die Zweige aus Chondroitinsulfat, Glucosaminsulfat, Dermatan und Keratan. (siehe Abbildung)
Proteoglykane haben eine hohe Kapazität Wassermoleküle zu binden. Sie verleihen dem Bindegewebe die typische gelatinöse Konsistenz. Proteoglykane befinden sich zwischen den Kollagen- und Elastinfasern und dank ihrer starken Fähigkeit, Wassermoleküle zu binden, ernähren sie das umliegende Gewebe und transportieren Moleküle zu den Zellen. Die Form der Proteoglykane kann man sich wie den Stamm eines Tannenbaums vorstellen: Der Stamm besteht aus Hyaluronsäure und die Zweige aus Chondroitinsulfat, Glucosaminsulfat, Dermatan und Keratan. (siehe Abbildung)
Abbildung: Proteoglykan
Mit zunehmendem Alter nimmt die Synthese von Kollagen, Elastin und Proteoglykanen (insbesondere Chondroitinsulfate) auf natürliche Weise ab. Die produzierenden Zellen (Chondroblasten und Fibroblasten) werden mit zunehmendem Alter weniger produktiv.

